Opzioni terapeutiche
Ottenete maggiori informazioni sulle attuali opzioni terapeutiche per la macroglobulinemia di Waldenström.
Trattamento della macroglobulinemia di Waldenström
- Una serie di linee guida sulla pratica clinica sono offerte da ESMO (2018, aggiornamento programmato) e NCCN.1,2
- Generalmente i pazienti asintomatici non vengono trattati (“vigile attesa”).3
- Nonostante un decorso clinico indolente, il trattamento tempestivo della macroglobulinemia di Waldenström nei pazienti sintomatici può essere essenziale per gestire anemia, neuropatia e altri sintomi e per evitare danni irreparabili agli organi o complicazioni potenzialmente fatali (come la sindrome da iperviscosità).4
- Secondo le linee guida di consenso per il trattamento del decimo International Workshop for Waldenström Macroglobulinaemia (IWWM), le opzioni terapeutiche di prima linea per i pazienti sintomatici affetti da macroglobulinemia di Waldenström prevedono l’utilizzo di farmaci alchilanti (ad es. bendamustina, ciclofosfamide) e inibitori del proteasoma (ad es. bortezomib, carfilzomib, ixazomib), alcuni in combinazione con desametasone ed entrambi in combinazione con rituximab.5
- L’approvazione dell’inibitore orale della tirosin-chinasi di Bruton (BTKi) ibrutinib da solo e in combinazione con rituximab ha ampliato le opzioni di trattamento per i pazienti affetti da WM, e l’inibizione di BTK rappresenta uno standard di cura emergente.6
- Per i pazienti trattati in precedenza che hanno mostrato una risposta iniziale duratura, si raccomanda il riutilizzo di un regime precedente o di un altro regime terapeutico primario.5
- I pazienti possono partecipare a studi clinici in seguito alla consultazione del proprio fornitore di assistenza sanitaria e alla valutazione dei criteri di idoneità per lo studio.2
- La strategia di trattamento dipende dalle caratteristiche del paziente e della patologia, dal profilo genomico (mutazioni di MYD88/CXCR4), dalla disponibilità regionale di farmaci e linee guida, e dall’entità dei sintomi e del coinvolgimento degli organi.7
Fattori che determinano la scelta delle attuali opzioni di trattamento per la macroglobulinemia di Waldenström
In questo estratto dal simposio satellite BeiGene in occasione di EHA 20207,la prof.ssa Véronique Leblond esamina i fattori che determinano la scelta delle attuali opzioni di trattamento per la macroglobulinemia di Waldenström. La prof.ssa Leblond spiega come la scelta del trattamento dipenda dalle caratteristiche del paziente, dalle caratteristiche della patologia, dal profilo genomico e dalla disponibilità dei farmaci.
Le caratteristiche del paziente che influenzano la scelta del trattamento includono performance status, comorbidità ed età. I pazienti più giovani possono essere candidati per una terapia ad alto dosaggio. Gli analoghi nucleosidici devono essere evitati in quanto compromettono il prelievo di cellule staminali.5,4
Le caratteristiche della patologia che influenzano la scelta del trattamento includono i livelli di citopenia, la necessità di un controllo rapido della malattia e la presenza di neuropatia (in presenza di quest’ultima, gli inibitori del proteasoma devono essere evitati).). Il profilo genetico influisce sulla scelta del trattamento, ad esempio la presenza di mutazioni di MYD88 e CXCR4.5,4
Discussione dell’importanza dell’inibizione della BTK nei tumori maligni dei linfociti B come la macroglobulinemia di Waldenström
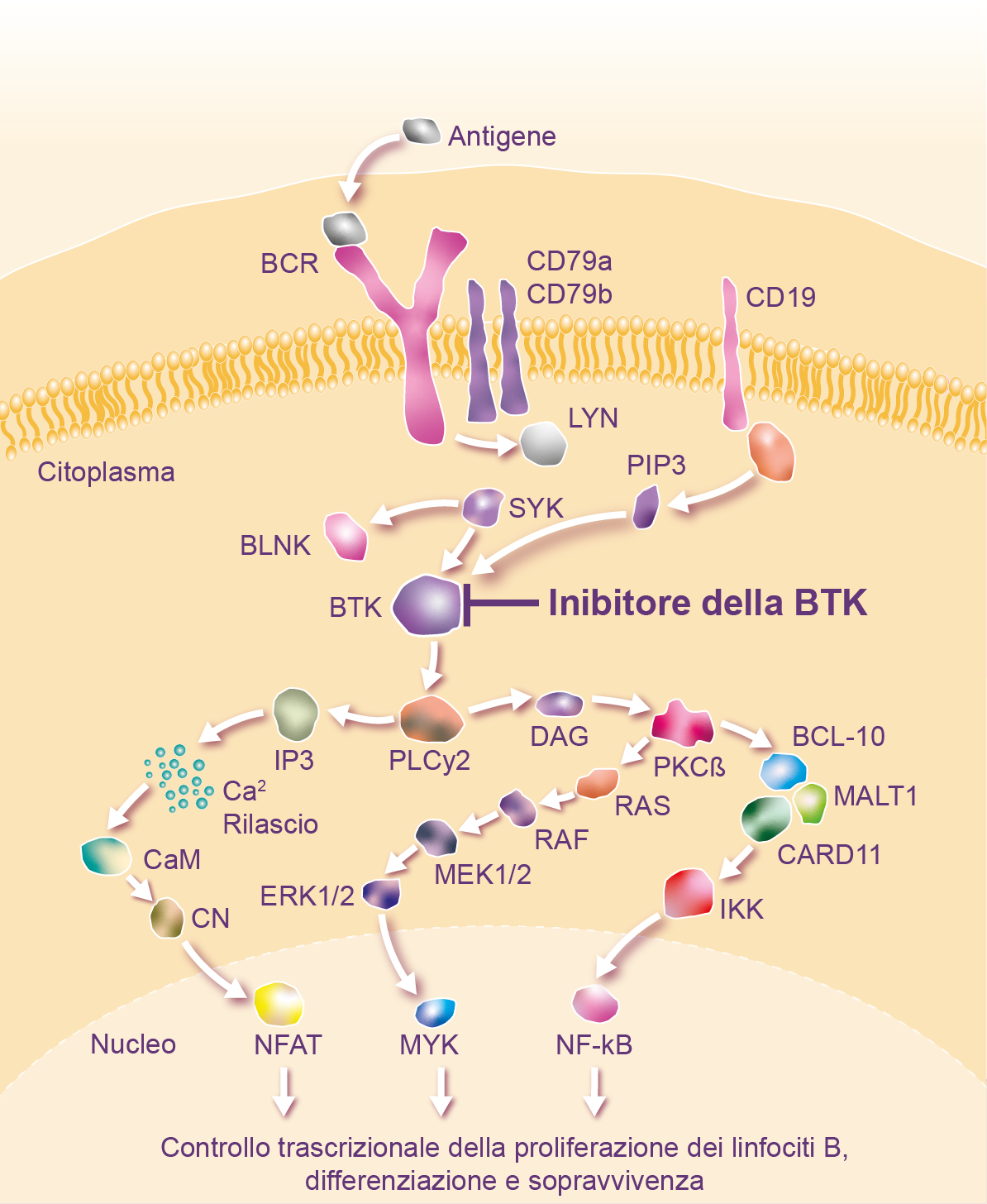
La BTK riveste un ruolo essenziale nello sviluppo e nella funzione dei linfociti B. In seguito all’attivazione da parte degli effettori upstream, la BTK innesca vie di segnalazione che, a loro volta, promuovono l’espressione di geni coinvolti nella proliferazione e nella sopravvivenza. L’attivazione costitutiva del recettore dei linfociti B e, di conseguenza, della BTK contribuisce alla patogenesi dei linfomi a linfociti B.8
La BTK è pertanto un importante target terapeutico nel trattamento dei tumori maligni dei linfociti B.8
I linfociti B maligni iperesprimono la BTK e i dati preclinici suggeriscono che, anche quando vengono inibiti farmacologicamente, una nuova sintesi della BTK può contribuire alla ripresa della produzione di cellule cancerose.9
Questa iperespressione della BTK innesca vie di segnalazione che, a loro volta, promuovono l’espressione di geni coinvolti nella proliferazione e nella sopravvivenza dei linfociti B maligni. Pertanto, l’inibizione completa e prolungata della BTK può essere importante nel controllo dei tumori maligni dei linfociti B.
Senza un’inibizione completa e continua della BTK, le interruzioni potrebbero permettere alla proteina BTK di nuova sintesi di continuare a segnalare la proliferazione nei linfociti B maligni. Inoltre, gli inibitori della BTK devono raggiungere i tessuti rilevanti per la malattia, inclusi linfonodi, milza, midollo osseo e sangue periferico, nonché il sistema nervoso centrale, dove può svilupparsi il linfoma primario.
L’inibitore della BTK ibrutinib è attualmente la terapia di elezione per i pazienti che hanno presentato una recidiva entro 12 mesi dalla chemioimmunoterapia, inclusi i pazienti refrattari a rituximab e i pazienti non idonei alla chemioimmunoterapia di prima linea. Per i pazienti con recidive tardive in seguito alla chemioimmunoterapia, il ricorso a ibrutinib è considerato un’altra opzione.1 Il follow-up a lungo termine della monoterapia a base di ibrutinib in pazienti sintomatici con macroglobulinemia di Waldenström precedentemente trattati ha mostrato che, dopo un tempo mediano di follow-up di 59 mesi, i tassi di risposta complessiva e di risposta maggiore sono stati rispettivamente del 90,5% e del 79,4%. Soprattutto, la sopravvivenza mediana libera da progressione in pazienti con WM precedentemente trattati è stata superiore a 5 anni ed è stata influenzata dallo stato di mutazione di MYD88 e CXCR4. Gli eventi avversi di Grado ≥3 osservati in più di un paziente e presumibilmente correlati alla terapia con ibrutinib comprendevano neutropenia (15,9%), trombocitopenia (11,1%) e polmonite (3,2%).10
Illustrazione: Controllo trascrizionale della proliferazione, differenziazione e sopravvivenza dei linfociti B. Adattata da Pal Singh S, et al. Mol Cancer. 2018;17(1):57, Merolle MI, et al. Oncotarget. 2018;9(38):25332-25341, Hendriks RW, et al. Nat Rev Cancer. 2014;14(4):219-232. 8,11,12
Opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström naïve al trattamento
Lezione: : la prof.ssa Véronique Leblond esamina le opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström naïve al trattamento.
In questo estratto dal simposio satellite BeiGene in occasione di EHA 20207, la prof.ssa Véronique Leblond esamina le attuali opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström naïve al trattamento. La prof.ssa Leblond spiega che l’immunochemioterapia, che generalmente consiste in un regime a base di rituximab in combinazione con bendamustina o ciclofosfamide, viene utilizzata di frequente in Europa. La prof.ssa sostiene che rituximab-bendamustina è più attivo rispetto a rituximab-ciclofosfamide, ma è più tossico ed è associato a una maggiore tossicità ematologica, citopenia prolungata ed eruzioni cutanee.13,14,15,16
La prof.ssa Leblond illustra alcune modifiche al trattamento a seconda delle caratteristiche del paziente. Ad esempio, nei pazienti fragili, è possibile ridurre il numero di cicli e dosi. In caso di iperviscosità, è necessario utilizzare la plasmaferesi in concomitanza con la terapia sistemica. In caso di livelli elevati di IgM o in presenza di un alto rischio di complicazioni correlate alle IgM (ad es. crioglobulinemia, malattia di von Willebrand acquisita), la plasmaferesi potrebbe essere utilizzata preventivamente. La prof.ssa Leblond prosegue illustrando altre opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström naïve al trattamento, ad esempio la combinazione di rituximab con un inibitore del proteasoma. L’inibitore del proteasoma più utilizzato è bortezomib, somministrato in combinazione con rituximab e con o senza desametasone.17,18,19 La sopravvivenza mediana libera da progressione (PFS) con questa combinazione è compresa tra 43 e 66 mesi. Rituximab può essere utilizzato in monoterapia nella neuropatia da anticorpi anti-MAG, nella crioglobulinemia o nei pazienti particolarmente fragili.20,21,22 Il tasso di risposta complessiva è piuttosto basso, con una breve sopravvivenza libera da progressione (PFS) (>2 anni). In Europa, ibrutinib in monoterapia è indicato per il trattamento di pazienti adulti affetti da macroglobulinemia di Waldenström (WM) che hanno ricevuto almeno una terapia precedente, oppure nel trattamento di prima linea per i pazienti non idonei a ricevere la chemioimmunoterapia. Ibrutinib in combinazione con rituximab è indicato per il trattamento di pazienti adulti affetti da WM. I tassi di risposta complessiva (ORR) sono elevati, con l’82% dei pazienti che ha raggiunto una sopravvivenza libera da progressione a 30 mesi.23,24
Opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström recidivante/refrattaria
In questo estratto dal simposio satellite BeiGene in occasione di EHA 20207, la prof.ssa Véronique Leblond analizza le opzioni di trattamento per i pazienti affetti da macroglobulinemia di Waldenström recidivante/refrattaria. In questo contesto, è possibile utilizzare regimi alternativi a base di rituximab al momento della recidiva, alternati o ripetuti in base alla durata della risposta. Ibrutinib è approvato per l’uso in questo contesto in Europa. Per i pazienti che hanno presentato una recidiva entro 12 mesi dalla chemioimmunoterapia, inclusi i pazienti refrattari a rituximab, ibrutinib in monoterapia è il trattamento di elezione.25,26
Il rischio di sanguinamento, ipertensione (13%) e aritmia atriale (12%) è maggiore durante il trattamento con ibrutinib. La prof.ssa Leblond esamina le opzioni relative al trapianto di cellule staminali (SCT). Il trapianto autologo di cellule staminali non è appropriato nell’ambito della terapia di prima linea in pazienti idonei che rispondono alla terapia di induzione. Il trapianto autologo di cellule staminali è appropriato dopo la seconda o successive recidive in pazienti idonei ad alto rischio affetti da malattia sensibile alla chemioterapia e deve essere preso in considerazione nei pazienti naïve al trattamento con inibitori della tirosin-chinasi di Bruton (BTKi). Il trapianto allogenico di cellule staminali è un trattamento curativo ma limitato al di fuori degli studi clinici e deve essere preso in considerazione solo in pazienti giovani altamente selezionati affetti da malattia aggressiva, che non hanno risposto o sono resistenti agli inibitori della BTK.