FASE II: TIRABRUTINIB
Ottenete maggiori informazioni sui più recenti studi clinici sulla macroglobulinemia di Waldenström.
Studio di fase II su tirabrutinib per la macroglobulinemia di Waldenström
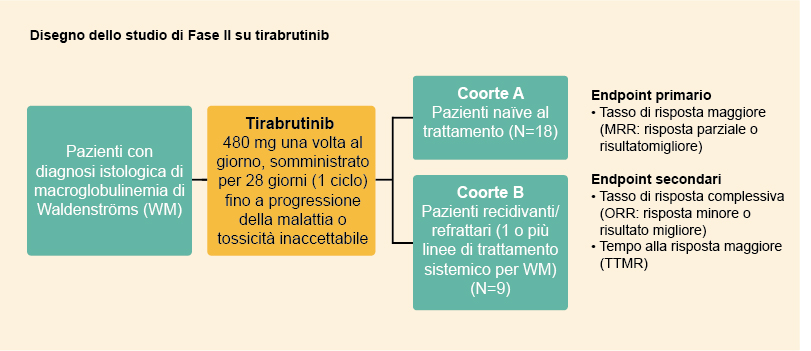
Disegno dello studio
- Lo studio è stato condotto con un disegno in aperto e a braccio singolo presso 19 centri in Giappone
- Criteri di inclusione per la Coorte A
- Presenza di WM sintomatica o livelli delle IgM sieriche >4.000 mg/dl
- Altri criteri di idoneità principali per entrambe le coorti
- Età ≥20 anni
- Gammopatia monoclonale con livelli delle IgM sieriche >500 mg/dl
- Punteggio ECOG PS (performance status secondo l’Eastern Cooperative Oncology Group) di 0 o 1
- Acceptable laboratory test results
- Criteri di esclusione principali
- Lesioni tumorali nel sistema nervoso centrale (SNC) e precedente somministrazione di inibitori della BTK
- I pazienti sono stati trattati con tirabrutinib 480 mg assunto a digiuno per via orale una volta al giorno, per 28 giorni in un unico ciclo
- Tirabrutinib è stato assunto fino alla progressione della malattia o fino al manifestarsi di una tossicità clinicamente non accettabile
Figura 1: Disegno dello studio di fase II su tirabrutinib. Ripresa da Sekiguchi N, et al. Cancer Sci. 2020;111(9):3327-3337.1
Popolazione di pazienti
- L’età mediana era di 71 anni
- Il livello mediano delle immunoglobuline M (IgM) nel siero era di 3.600 mg/dl
- La mutazione di MYD88L265P era presente nel 96,2% dei pazienti
Risultati
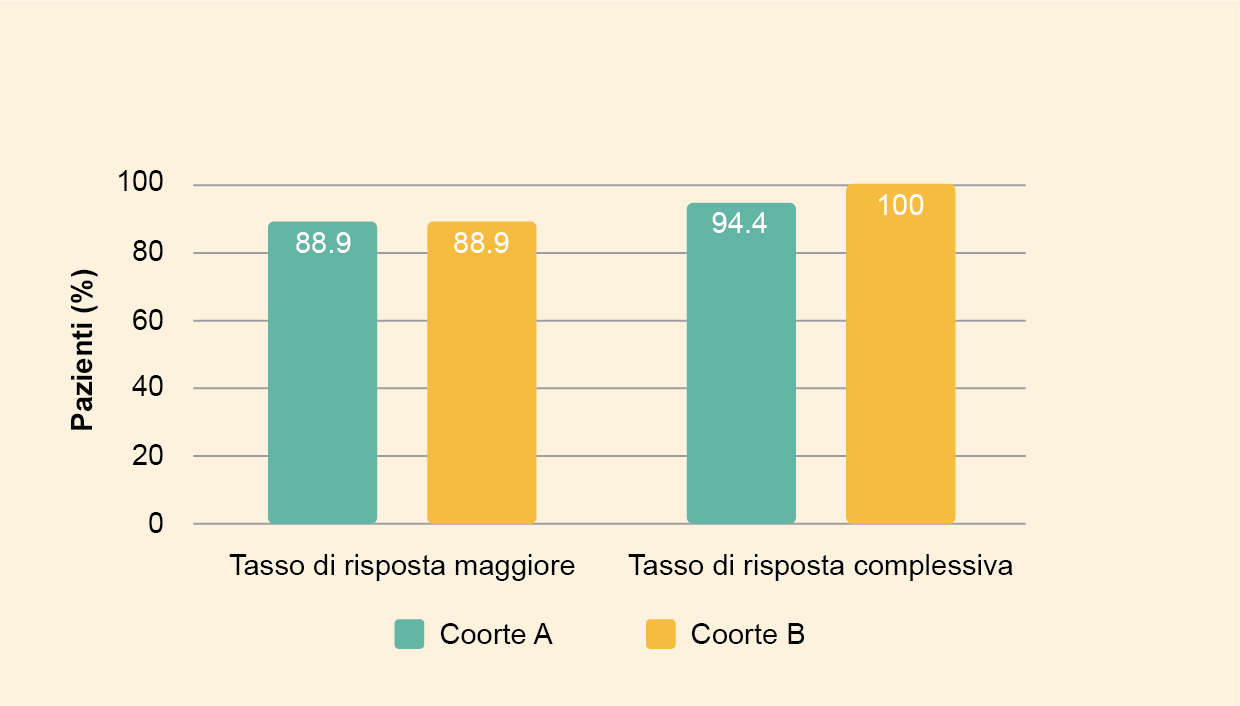
Risposte
- I tassi MRR e ORR sono stati rispettivamente dell’88,9% e del 96,3% (Figura 2)
- Il tempo mediano fino al raggiungimento di una risposta maggiore è stato di 1,87 mesi
PFS e OS
- Gli eventi avversi (EA) più comuni sono stati eruzione cutanea (44,4%), neutropenia (25,9%) e leucopenia (22,2%)
Sicurezza
- Gli eventi avversi (EA) più comuni sono stati eruzione cutanea (44,4%), neutropenia (25,9%) e leucopenia (22,2%)
- La maggior parte degli EA è stata classificata di Grado 1 o 2
- Grade ≥ 3 AEs included neutropenia (11.1%), lymphopenia (11.1%), and leukopenia (7.4%)
- Non sono stati osservati EA di Grado 5
- Tutti gli eventi di sanguinamento sono stati di Grado 1; nessuno di essi era associato a fibrillazione atriale o ipertensione correlata al farmaco.
Riepilogo
- Anche se la durata del follow-up è stata relativamente breve, lo studio ha raggiunto l’endpoint primario (tasso di risposta maggiore).
- Il presente studio ha dimostrato che tirabrutinib in monoterapia è altamente efficace in termini di rapidità della risposta ed è ben tollerato sia nei pazienti naïve al trattamento che nei pazienti affetti da WM sintomatica recidivante/refrattaria.
- Non è stato possibile valutare alcuni endpoint di efficacia (tra cui PFS e OS) a causa del limitato periodo di osservazione; pertanto si rendono necessari studi futuri che prevedano un periodo di follow-up più lungo.